La maladie de Parkinson est l'une des maladies neurologiques les plus fréquentes. On estime à environ 6,3 millions le nombre de personnes atteintes dans le monde. Les malades souffrent principalement de troubles de la motricité et de la mobilité, de tremblements gênants au repos et de troubles de la marche. Pour atténuer les souffrances liées à cette maladie, il est très important d'adapter précisément le traitement aux besoins individuels du patient. En cas de stimulation cérébrale profonde, nous la réalisons régulièrement à l'Inselspital sous anesthésie générale. La condition préalable est toutefois un haut degré d'expertise et beaucoup d'expérience de la part des médecins traitants.
Qui est touché par la maladie de Parkinson?
Il y a environ 15 000 patients atteints de la maladie de Parkinson en Suisse. Chaque année, environ 3000 nouveaux patients sont atteints de la maladie de Parkinson en Suisse. Les hommes sont un peu plus souvent touchés que les femmes. L'âge moyen de la maladie se situe entre 65 et 70 ans.
Comment se développe la maladie de Parkinson?
On estime que, dans la plupart des cas, une combinaison d'influences environnementales externes et de facteurs héréditaires est à l'origine de la maladie de Parkinson. Dans de rares cas (5 à 10 % des patients atteints de la maladie de Parkinson), la maladie est d'origine génétique. Des mutations dans certains gènes (PARK 1-16) sont transmises et peuvent entraîner la maladie de Parkinson. Cette forme est appelée variante monogénique. Les patients concernés tombent généralement malades avant l'âge de 40 ans.
La maladie de Parkinson est une maladie neurodégénérative dans laquelle on constate, au microscope, une destruction progressive des cellules nerveuses dans certaines régions du cerveau. La substantia nigra, une structure nucléaire située dans la région du mésencéphale, est particulièrement touchée. C'est là que la dopamine, un neurotransmetteur, est produite. Le signal de dopamine de la substantia nigra est essentiel pour le contrôle du comportement. Il régule le traitement des informations dans les ganglions de la base - un ensemble de noyaux situés en profondeur dans le cerveau - qui jouent un rôle central dans la planification et la sélection des comportements et de la motricité. En termes simples, le signal de la dopamine déclenche certaines activités tout en en inhibant d'autres, permettant ainsi un comportement coordonné. De plus, la dopamine est importante pour l'apprentissage moteur et la gestion de la motivation.
Au fur et à mesure que la maladie progresse, les cellules nerveuses d'autres régions du cerveau qui ne produisent pas de dopamine sont également touchées. Cela entraîne de nombreux symptômes (troubles végétatifs, douleurs, troubles du sommeil, troubles psychiques) qui deviennent de plus en plus pénibles pour le patient à mesure que la maladie évolue. C'est le cas par exemple du noyau pédonculopontin situé dans le tronc cérébral, qui occupe des fonctions importantes dans le contrôle de la stabilité de la marche et la régulation de l'attention et du sommeil.
Quels sont les symptômes typiques de la maladie de Parkinson?
Le symptôme cardinal de la maladie de Parkinson est la perturbation des fonctions motrices, le ralentissement des mouvements jusqu'à l'immobilité (bradykinésie, hypokinésie, akinésie). D'autres symptômes principaux peuvent s'y ajouter, avec une intensité variable selon les individus:
- tremblements (tremor)
- rigidité musculaire (rigor)
- instabilité posturale avec tendance à la chute
En outre, symptômes non moteurs peuvent survenir dans le cadre de la maladie de Parkinson:
- symptômes végétatifs
- symptômes psychiques
- symptômes cognitifs
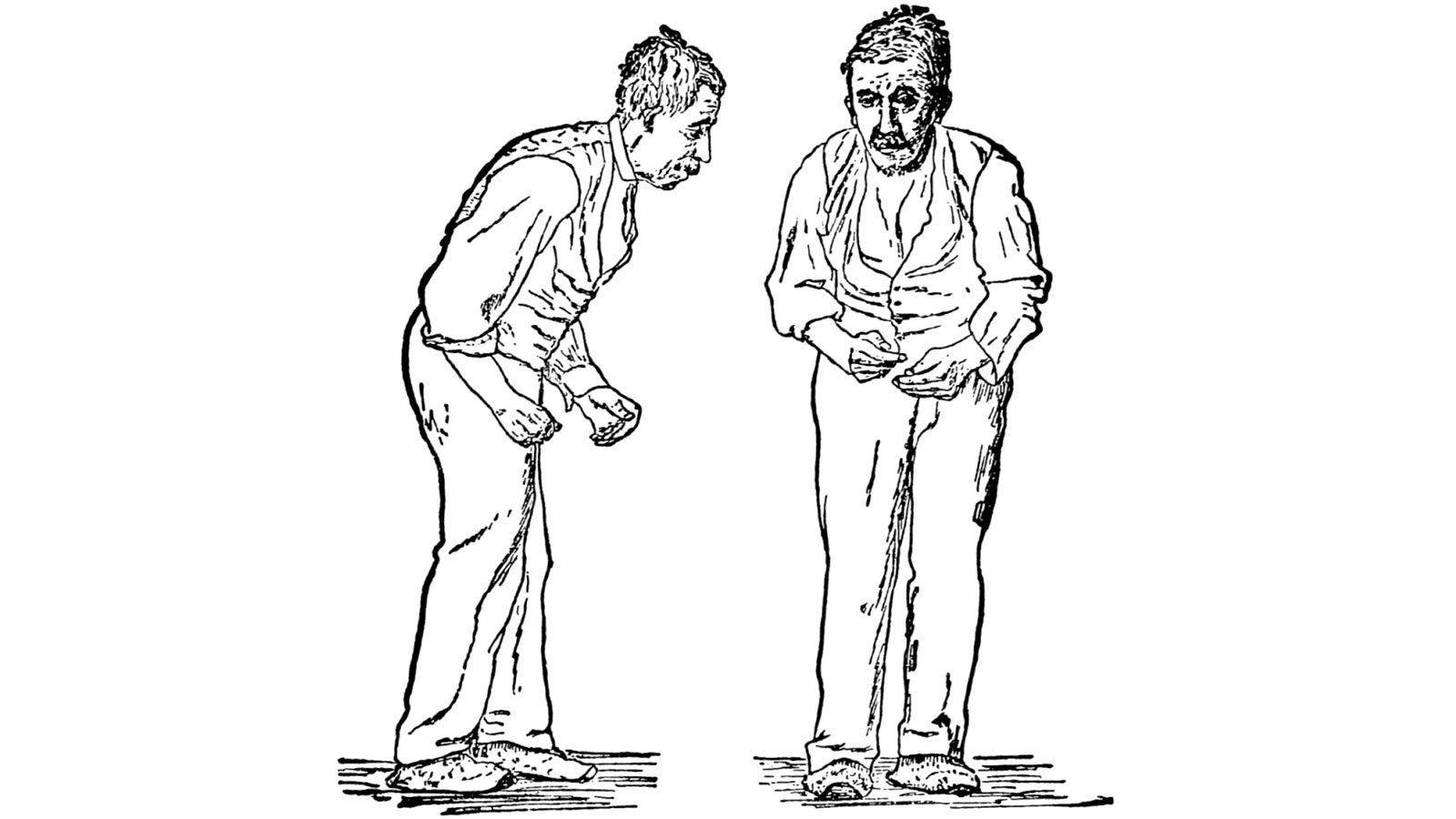
Bradykinésie, hypokinésie, akinésie
La bradykinésie est un ralentissement de la motricité volontaire. Les patients atteints sont moins capables de passer rapidement d'une tâche ou d'un mouvement à l'autre et leurs activités sont généralement ralenties. En pratique, la démarche se fait à petits pas, l'écriture est plus petite et moins dynamique, l'élocution plus lente, la déglutition moins fréquente, etc. Au début, les patients le remarquent lors d'activités avec leurs mains, comme écrire ou jouer d'un instrument de musique. Ces symptômes augmentent au fur et à mesure que la maladie progresse.
L'absence de mouvement ou la mobilité réduite est appelée hypokinésie.
Un degré élevé des symptômes allant jusqu'à l'immobilité est appelé akinésie.
Tremblements
Les tremblement sont généralement des tremblements de repos des extrémités, c'est-à-dire des tremblements sans mouvement volontaire pendant la relaxation physique. Le tremblement rythmique typique des doigts ressemble au mouvement des doigts lors de la rotation de la pilule et est donc souvent appelé un tremblement de roulement de pilule. Le tremblement diminue dès que l'on bouge volontairement les membres affectés. En règle générale, le tremblement s'intensifie en cas d'effort émotionnel ou mental.
Rigidité
Le syndrome de Parkinson augmente en permanence le tonus musculaire tout au long des mouvements. En raison de cette rigidité musculaire, les patients ont l'impression que leurs membres sont «comme paralysés» et souffrent aussi souvent de crampes douloureuses.
Instabilité posturale
La marche droite et l'équilibre sont perturbés, et la posture droite devient de plus en plus difficile à mesure que la maladie progresse. Pour cette raison, les chutes sont une conséquence dangereuse possible de la maladie de Parkinson.
Freezing of gait
Les patients peuvent également souffrir d'un trouble spécifique de la démarche appelé en anglais «Freezing of gait». Il s'agit d'un blocage soudain et imprévisible de la démarche des patients atteints de la maladie de Parkinson. La personne affectée semble figée ou bloquée sur place. En raison de la posture penchée en avant de la plupart des patients atteints de la maladie de Parkinson, ces blocages peuvent entraîner des pertes d'équilibre et des chutes peuvent *.
Symptômes non-moteurs
Bien que la maladie de Parkinson soit considérée comme un trouble classique du mouvement et que les symptômes moteurs soient la principale cause de préoccupation des patients, d'autres symptômes non moteurs accompagnent la maladie de Parkinson :
- troubles végétatifs : troubles de la miction, troubles de la tension artérielle, troubles de la régulation de la température, troubles du sommeil.
- troubles psychiques : dépression, anxiété
- troubles cognitifs : troubles du comportement, démence
- troubles sensoriels : troubles visuels, troubles olfactifs, troubles sensoriels.
Les troubles cognitifs se manifestent souvent à un stade avancé de la maladie et, dans le pire des cas, aboutissent à la démence. Cette démence de Parkinson diffère cliniquement de la forme de démence la plus connue, la maladie d'Alzheimer. Alors que la maladie d'Alzheimer entraîne principalement des troubles de la mémoire, la maladie de Parkinson provoque surtout des troubles du comportement tels que l'apraxie. Cela signifie que le patient affecté ne peut plus effectuer correctement des mouvements complexes, comme faire du café, s'habiller, etc.
Quelles sont les formes de la maladie de Parkinson?
En fonction des principaux symptômes qui sont particulièrement prononcés, on distingue différents types de maladie de Parkinson :
- Type akinétique-rigide : le manque de mobilité et la rigidité sont au premier plan.
- Type à dominance de tremblement : tremblement prononcé, moins de rigidité, de bradykinésie et d'instabilité posturale.
- Type d'équivalence : les principaux symptômes classiques d'akinésie de rigidité et de tremblement sont plus ou moins également prononcés.
Les symptômes de la maladie de Parkinson peuvent également apparaître dans le contexte d'autres maladies du système nerveux. Le pronostic est différent dans ce cas, et les patients atteints ne répondent pas ou mal aux thérapies habituelles (traitement médicamenteux ou neuromodulation). Le diagnostic de ces syndromes parkinsoniens atypiques est donc important tant sur le plan pronostique que thérapeutique.
Les syndromes parkinsoniens atypiques sont :
- Atrophies multisystèmes (AMS).
- Démence à corps de Lewy
- Paralysie supranucléaire progressive du regard (PSP)
- Dégénérescence ganglionnaire corticobasale (DBC)
Comment diagnostique-t-on la maladie de Parkinson?
Le diagnostic de la maladie de Parkinson est posé cliniquement. L'histoire de la maladie et les résultats de l'examen neurologique sont d'une importance capitale. Les symptômes individuels peuvent être gradués cliniquement et sont utilisés pour l’établissement du stade de la maladie. Cette évaluation est effectuée à l'aide de l'échelle de Hoehn et Yahr (Hoehn 1967) et de l'échelle unifiée d'évaluation de la maladie de Parkinson (UPDRS). Les examens complémentaires tels que l'imagerie par résonance magnétique (IRM), la scintigraphie du transporteur de la dopamine (DAT scan), le diagnostic du liquide céphalo-rachidien (LCR), etc. ne sont utilisés qu'à titre de mesures de soutien pour exclure les syndromes parkinsoniens.
Quelles sont les possibilités de traitement pour les patients atteints de la maladie de Parkinson?
Pour un traitement adéquat de la maladie de Parkinson, une coopération étroite entre plusieurs disciplines est indispensable. Le traitement médicamenteux est la première priorité et est effectué par des neurologues spécialisés dans le domaine des troubles du mouvement. Les interventions chirurgicales telles que les procédures lésionnelles ou la stimulation cérébrale profonde ou Deep Brain Stimulation (DBS) jouent un rôle important dans la thérapie. Ces procédures sont hautement spécialisées et nécessitent une solide formation dans le domaine de la neurochirurgie fonctionnelle. L'étroite collaboration interdisciplinaire entre les neurologues et les neurochirurgiens fonctionnels de l'Inselspital garantit un traitement intégral de qualité et, surtout, personnalisé pour chaque patient.
Traitement médicamenteux
La disparition des cellules nerveuses de la substantia nigra, qui libèrent la dopamine en tant que neurotransmetteur, entraîne un dysfonctionnement des circuits des ganglions de la base. En termes très simplifiés, le manque de dopamine conduit à un déséquilibre dopamine/acétylcholine dans la transmission des signaux entre les cellules nerveuses. Le traitement médicamenteux vise principalement à rétablir cet équilibre. Les médicaments suivants sont généralement utilisés à cette fin :
L-Dopa
La L-Dopa est un précurseur de la dopamine et est convertie en dopamine dans le cerveau par l'enzyme DOPA décarboxylase (DDC). La L-Dopa est le médicament le plus efficace et le mieux toléré pour traiter les symptômes de la maladie de Parkinson et constitue actuellement le médicament de choix. Elle améliore principalement l'akinésie et la rigidité, mais moins le tremblement. Des observations à long terme ont montré qu'après plusieurs années de traitement à la L-Dopa, une diminution progressive de l'effet se produit et celle-ci conduit à des fluctuations motrices importantes alternant des périodes d’hypokinésie/akinésie avec des pörodes d’hyperkinésie (dyskinésies) au cours de la journée.
Agonistes de la dopamine
Les agonistes dopaminergiques tels que le pramipexole, le ropinirole, la rotigotine, le piribedil agissent directement sur les récepteurs de la dopamine. Ils sont utilisés, entre autres, pour réduire la quantité de L-DOPA nécessaire et dans les cas où les patients ne répondent plus de manière fiable à la L-DOPA. Les agonistes de la dopamine présentent l'avantage de réduire les fluctuations motrices ainsi que les dyskinésies comme effet secondaire. Les inconvénients sont que des problèmes comportementaux tels que des troubles obsessionnels compulsifs ou une réduction du contrôle des impulsions ont été observés chez 15 % des patients pendant le traitement. Cela se manifeste, par exemple, par une dépendance au jeu, des dépenses d’argent excessives, une hypersexualité, etc.
Inhibiteurs de la monoamine oxydase de type B (IMAO-B)
Les IMAO-B (rasagiline) ont un effet dopaminergique en inhibant la dégradation de la dopamine. Ils sont généralement utilisés comme agent d'appoint pour renforcer l'effet de la L-DOPA et réduire les fluctuations motrices induites par la L-DOPA.Agonistes de la dopamine.
Anticholinergiques
Par exemple, le bensérazide. Ce traitement connu depuis longtemps inhibe la transmission du signal de l'acétylcholine. Ces médicaments restent importants dans les cas où les tremblements ou les troubles végétatifs dominent. L'effet sur l'akinésie et la rigueur est en arrière-plan. Les effets secondaires possibles sont des troubles de la mémoire et peuvent être un problème dans la maladie de Parkinson avancée.
La liste des médicaments énumérés ici n'est pas exhaustive. Les médicaments peuvent être utilisés individuellement ou en association.
Thérapie par injection
En plus des médicaments cités, l'apomorphine, un agoniste de la dopamine, peut également être utilisée sous forme d'administration continue sous-cutanée ou duodénale au travers d’une pompe (pompe à apomorphine). Cette thérapie entre en jeu lorsque le traitement médicamenteux par comprimés n'est plus suffisamment efficace. Outre les problèmes liés à la pompe, cette thérapie peut entraîner une augmentation des dyskinésies.
Traitement chirurgical
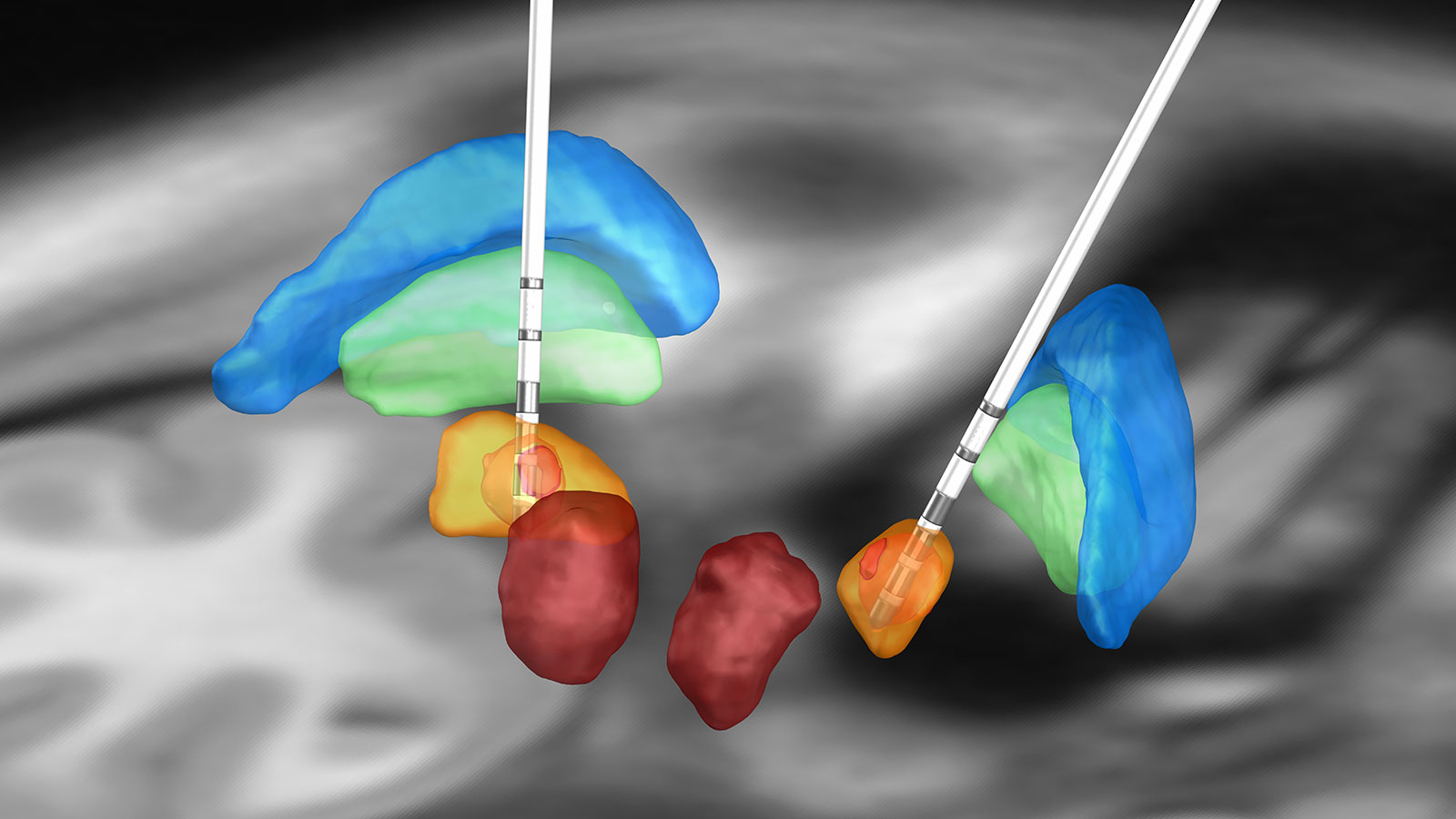
Le traitement neurochirurgical de la maladie de Parkinson est fait partie du spectre de la neurochirurgie fonctionnelle. L'histoire de la neurochirurgie fonctionnelle dans le traitement de la maladie de Parkinson remonte à la seconde moitié du XXe siècle. Le développement des techniques stéréotaxiques a permis de placer des sondes avec une précision millimétrique dans des zones cibles spécifiques du cerveau.
Classiquement, les sondes ainsi introduites permettaient de chauffer et donc de scléroser les tissus nerveux environnants *. Par ailleurs, la maladie de Parkinson a été traitée par la mise en place de petites lésions dans la région du globus pallidus interne (GPi) et du noyau sous-thalamique ainsi que, en cas de tremblement au premier plan, dans la région du thalamus moteur (noyau ventral intermédiaire, VIM). Des travaux pionniers menés dans les années 1990 par le neurochirurgien français Alim Louis Benabid ont montré que l'insertion d'électrodes de stimulation à haute fréquence dans ces régions du cerveau produisait le même effet, avec l'avantage de pouvoir mieux éviter les effets secondaires en adaptant l'intensité de la stimulation.
Cette nouvelle thérapie a été appelée stimulation cérébrale profonde ou Deep Brain Stimulation (DBS) et constitue aujourd'hui le traitement chirurgical standard à l'Inselspital *. Il existe trois structures cérébrales possibles pour la stimulation cérébrale profonde chez les patients atteints de la maladie de Parkinson :
- le noyau sous-thalamique (STN)
- le globus pallidus internus (GPi)
- le noyau ventral intermédiaire du thalamus (Vim)
Ces zones cibles possibles doivent être discutées individuellement en tant qu'alternatives pour chaque patient au sein du comité d'experts. La stimulation dans la région du noyau sous-thalamique (STN) est la cible de premier choix, car la stimulation permet également de traiter avec succès l'akinésie et la rigidité et de réduire considérablement les doses de médicaments. L'inconvénient potentiel est l'aggravation d'une instabilité posturale préexistante. Selon les études, la stimulation GPi est actuellement équivalente *.
Que peut attendre un patient atteint de la maladie de Parkinson de la stimulation cérébrale profonde?
La stimulation cérébrale profonde (SCP) dans la maladie de Parkinson ne peut ni guérir la maladie ni stopper le processus pathologique. Elle ne fait qu'atténuer les symptômes moteurs de la maladie de Parkinson tels que l'akinésie, les tremblements et la rigidité, et réduit les dyskinésies induites par les médicaments, c'est-à-dire les troubles de la motricité. L'effet de la SCP sur le soulagement des symptômes n'est pas beaucoup plus important que celui du traitement médicamenteux dopaminergique, mais il est plus constant tout au long de la journée. Les dyskinésies gênantes sont beaucoup plus rares. Si l'on stimule dans la région du noyau sous-thalamique, les médicaments peuvent en outre être réduits de moitié environ. Globalement, la stimulation cérébrale profonde entraîne une nette amélioration de la qualité de vie des patients - un fait qui a pu être mis en évidence dans plusieurs études de grande qualité.
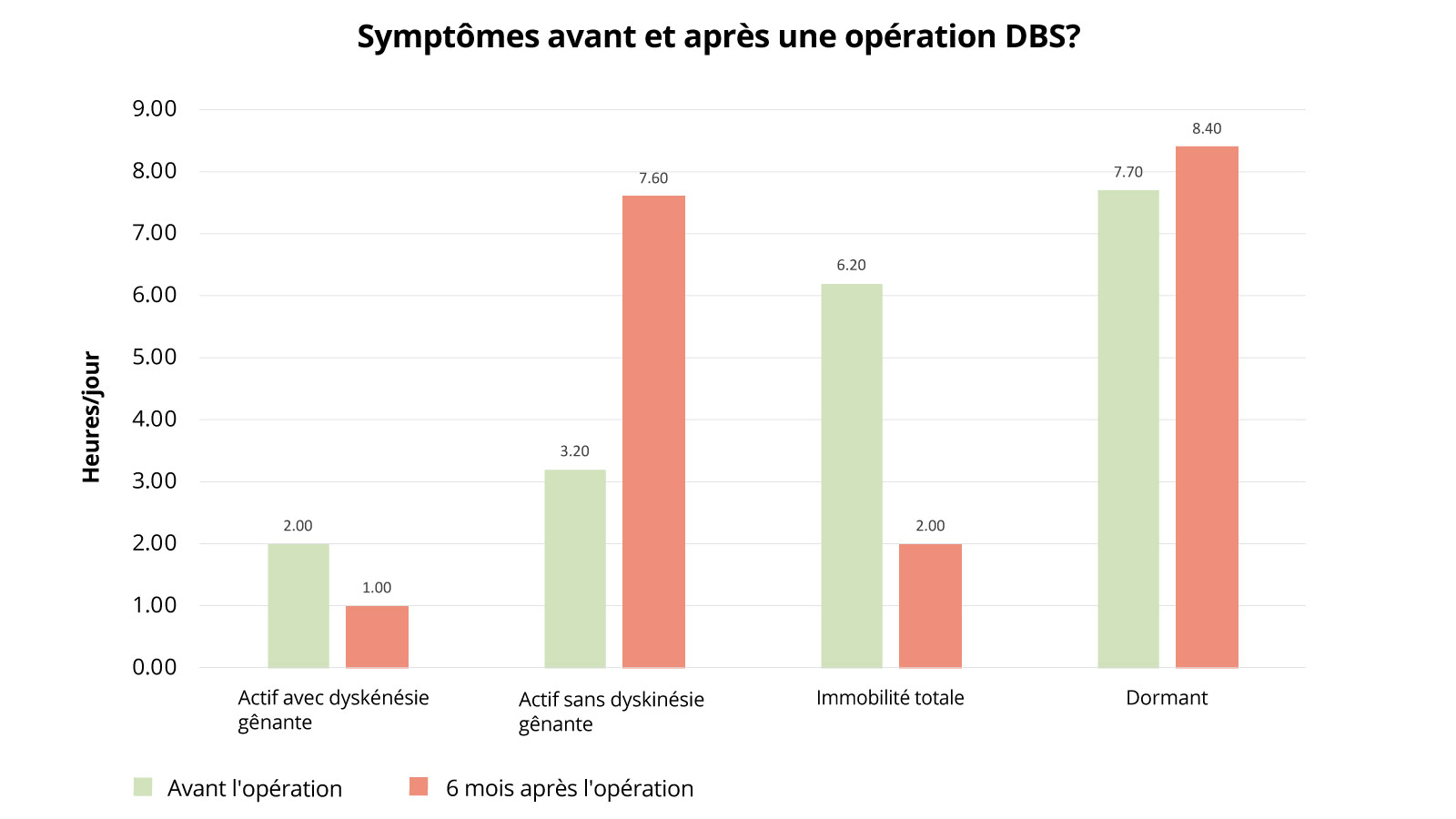
Symptômes avant et après une opération DBS?
Le graphique suivant montre comment l'état de santé des patients atteints de la maladie de Parkinson a évolué après une opération DBS. Sont examinées les périodes actives avec troubles moteurs, les périodes actives sans troubles moteurs, les périodes d'immobilité totale et les périodes de sommeil. L'état avant l'opération est comparé à l'état six mois après l'opération. Ce qui est frappant ici, c'est surtout le fait que les patients passent beaucoup moins de temps en état d'immobilité en postopératoire (6,2 heures avant l'opération contre 2 heures après), ils peuvent donc être nettement plus actifs. Ces temps d'activité sont également beaucoup moins chargés par des restrictions de mouvement qu'avant l'intervention (l'activité sans troubles moteurs contraignants était de 3,2 heures avant l'opération et de 7,6 heures après l'opération). Là aussi, une nette amélioration peut être démontrée.
À quels effets secondaires faut-il s'attendre en cas de stimulation cérébrale profonde?
En principe, les effets secondaires sont les mêmes que pour toutes les procédures DBS fonctionnelles stéréotaxiques. Les risques spécifiques à la stimulation GPi ou STN pour le traitement de la maladie de Parkinson peuvent être des perceptions transitoires de "flashs lumineux" lors de la stimulation du tractus optique, ainsi que des spasmes musculaires, des troubles de la parole (dysarthrie) ou des paresthésies sensitives. En règle générale, ces effets secondaires induits par la stimulation sont réversibles. Chez environ 10 à 15 % des patients, une détérioration de la cognition a été constatée dans de grandes études après l'implantation d'un DBS.
Tous les patients atteints de la maladie de Parkinson sont-ils éligibles à la stimulation cérébrale profonde?
Tous les patients ne sont pas éligibles pour un traitement chirurgical. Les candidats appropriés répondent aux critères suivants :
- Le patient présente de graves troubles moteurs (p. ex. dyskinésies) ou un tremblement important malgré un bon traitement médicamenteux.
- Le traitement médicamenteux du patient est soumis à de fortes variations et à des pertes d'efficacité soudaines au cours de la journée (wearing-off, fluctuations d'efficacité).
- Le patient ne présente pas de problèmes cognitifs graves (démence), de troubles du comportement ou de dépression.
Ce sont les tremblements, les fluctuations d'action et l'atténuation des dyskinésies qui répondent le mieux au traitement chirurgical. Les symptômes autonomes (fluctuations de la tension artérielle, troubles mictionnels, salivation, etc.) et les symptômes cognitifs (démence parkinsonienne) ne peuvent pas être améliorés en l'état actuel des choses. Cependant, plusieurs études sont actuellement en cours. La stimulation cérébrale profonde du noyau pédonculopontin donne des résultats mitigés dans le cas du freezing of gait *. La décision doit être prise au cas par cas. L'indication de la SCP est généralement posée conjointement par les neurologues et les neurochirurgiens après des examens longs (examens neurologiques, tests neuropsychologiques, évaluation psychiatrique, évaluation chirurgicale) afin de s'assurer que seuls les patients ayant de fortes chances d'améliorer leurs symptômes sont sélectionnés pour l'intervention.
Pourquoi se faire soigner à l'Inselspital?
Nous sommes le seul centre en Suisse à réaliser l'opération de la stimulation cérébrale profonde pour la maladie de Parkinson sous anesthésie générale de manière routinière.
Les avantages sont les suivants :
- Implantation très précise de l'électrode
- Pas d'opération éveillée contraignante
- Durée de l'opération plus courte
- Intervention plus douce pour nos patients
- Pas d'arrêt des médicaments contre la maladie de Parkinson avant l'opération
Le passage d'une opération à l'état de veille à une intervention sous anesthésie générale se base sur l'expérience de grands centres internationaux ainsi que sur des résultats publiés scientifiquement *. Depuis 2021 déjà, nous recommandons et pratiquons l'implantation d'électrodes et de stimulateurs sous anesthésie générale. Selon notre expérience, les résultats de l'opération sous anesthésie sont aussi bons, voire meilleurs, que ceux de l'opération en état d'éveil. La condition préalable est toutefois un haut degré d'expertise et beaucoup d'expérience de la part des médecins traitants. Nous avons également constaté que tous nos patients atteints de la maladie de Parkinson préféraient être opérés sous anesthésie générale.
Cette approche innovante a été rendue possible par :
- l'amélioration de l'imagerie moderne, qui permet d'implanter l'électrode avec précision et exactitude, même sous anesthésie générale
- le développement technologique des systèmes implantés (électrodes segmentées)
Comme dans le cas d'une opération éveillée, des signaux électrophysiologiques du cerveau sont dérivés pendant l'opération sous anesthésie générale et une stimulation test peropératoire est effectuée pour tester les effets secondaires. Le placement de l'électrode au millimètre près peut ainsi être contrôlé avec précision. En cas d'absence de dérivation des signaux cérébraux et/ou de survenue rapide d'effets secondaires, l'électrode est repositionnée et testée à nouveau.
Dans la mesure où cela est médicalement indiqué, l'intervention peut également être réalisée dans certains cas en état de veille. L'équipe soignante en discutera en détail avec vous au préalable et vous expliquera également le déroulement d'une opération en état d'éveil, si celle-ci s'avère nécessaire. Chez les patients souffrant de dystonie sévère, l'intervention doit cependant toujours être réalisée sous anesthésie générale.
-
Bluett B, Bayram E, Litvan I. The virtual reality of Parkinson’s disease freezing of gait: A systematic review. Parkinsonism & related disorders. 2019
-
Cif L, Hariz M. Seventy Years with the Globus Pallidus: Pallidal Surgery for Movement Disorders Between 1947 and 2017. Mov Disord. 2017;32:972-982.
-
Deuschl G, Schade-Brittinger C, Krack P et al. A Randomized Trial of Deep-Brain Stimulation for Parkinson's Disease. New England Journal of Medicine. 2006;355:896-908.
-
Odekerken VJJ, van Laar T, Staal MJ et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson’s disease (NSTAPS study): a randomised controlled trial. The Lancet Neurology. 2013;12:37-44.
-
Nowacki A, Galati S, Ai-Schlaeppi J, Bassetti C, Kaelin A, Pollo C. Pedunculopontine nucleus: an integrative view with implications on deep brain stimulation. Neurobiology of disease. 2019;128:75-85.
-
Holewijn RA, Verbaan D, van den Munckhof PM, Bot M, Geurtsen GJ, Dijk JM, Odekerken VJ, Beudel M, de Bie RMA, Schuurman PR. General Anesthesia vs Local Anesthesia in Microelectrode Recording-Guided Deep-Brain Stimulation for Parkinson Disease: The GALAXY Randomized Clinical Trial. JAMA Neurol. 2021 Oct 1;78(10):1212-1219.
