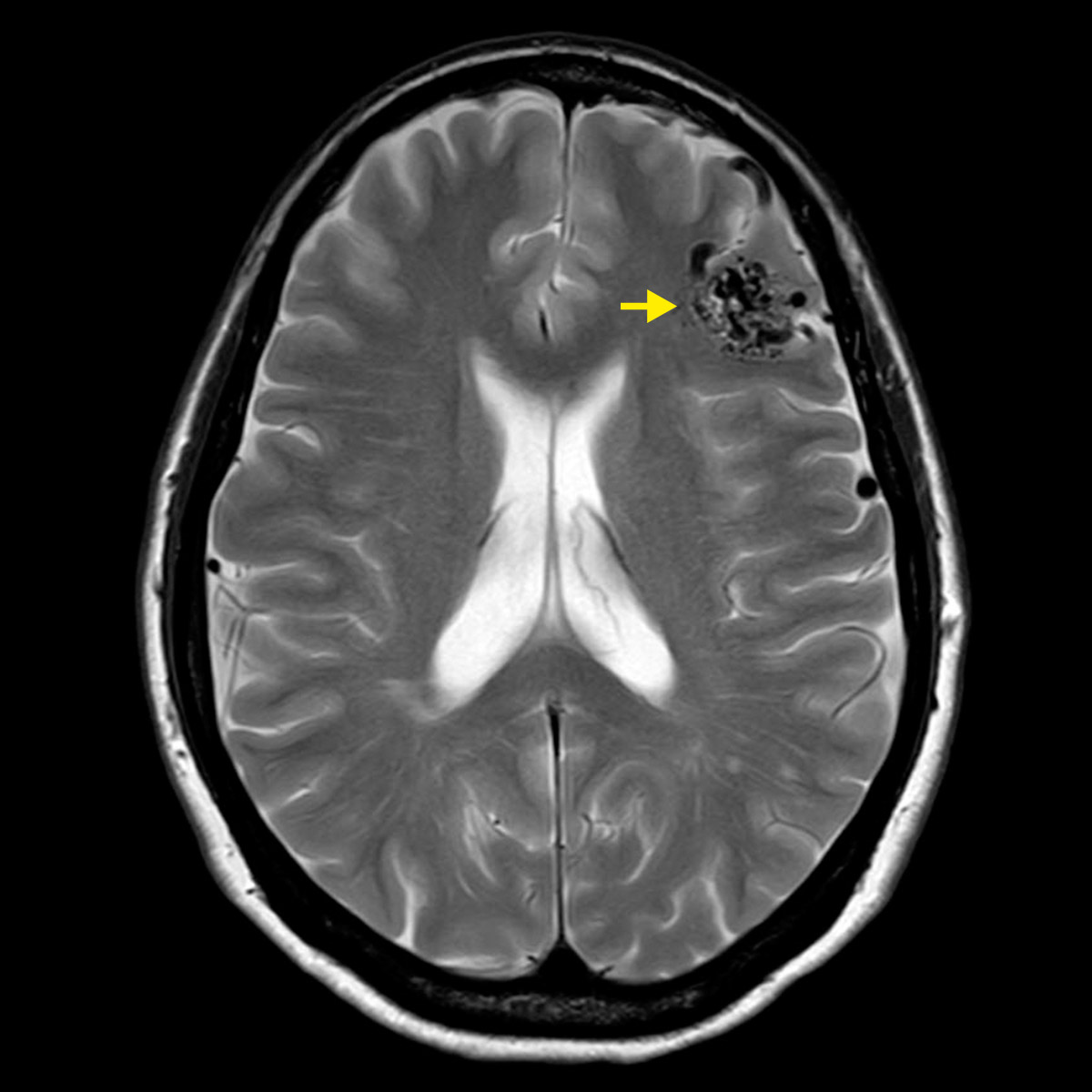
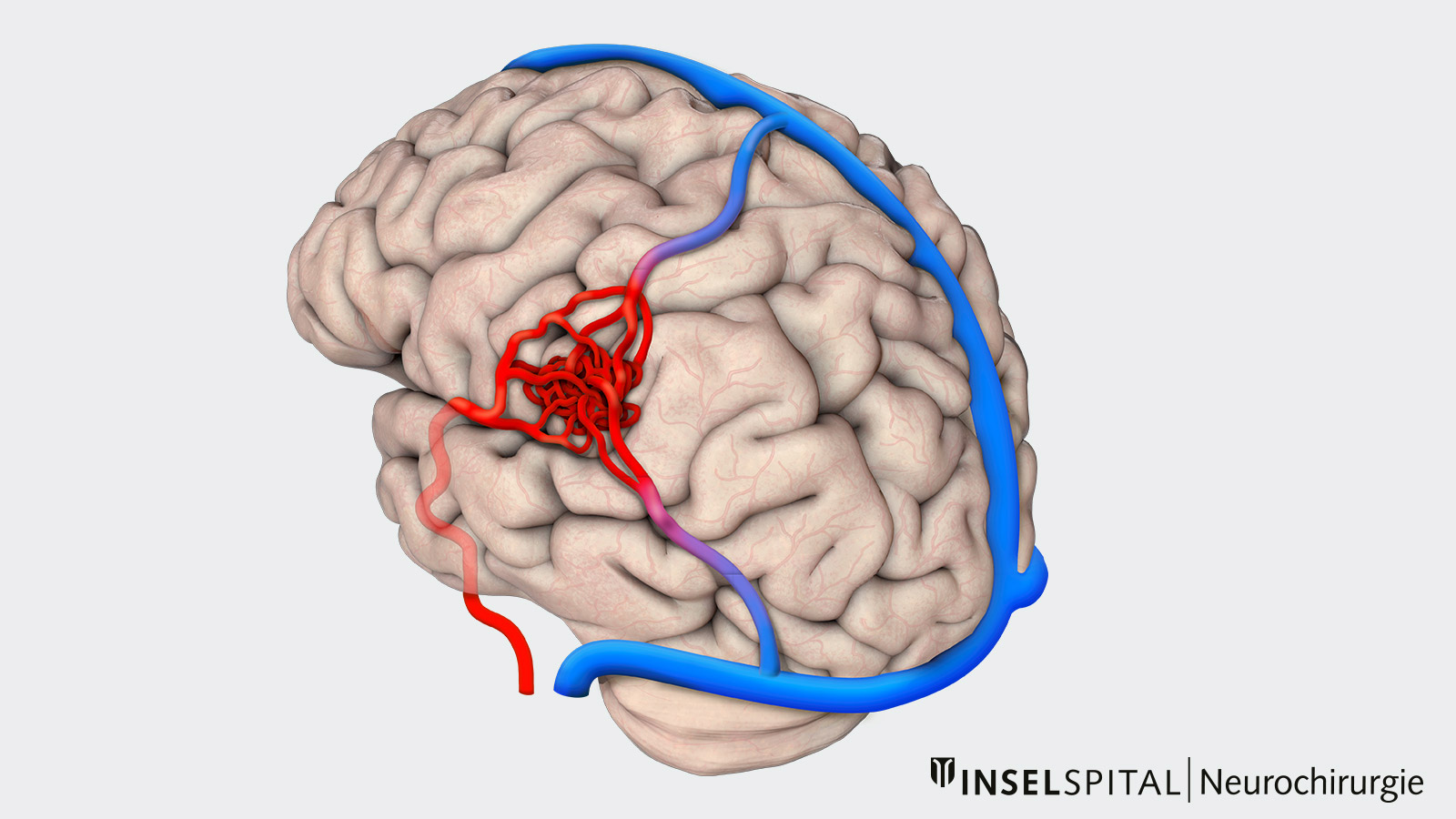
Les malformations artério-veineuses (MAV) sont des malformations vasculaires cérébrales. Il s'agit d'un réseau de vaisseaux anormal consistant en des artères et de veines qui communiquent directement au niveau d’un agrégat de vaisseaux atypique, que l’on appelle un « nidus ». C’est dans ce nidus que le sang s’écoule et se déverse dans des veines de drainage à pression élevés, dû au manque de réseaux capillaires. En cas de rupture d’une MAV, une hémorragie intracérébrale potentiellement grave avec dommages aux tissus cérébraux environnants peut donc se produire.
Quelle est la fréquence d'une MAV cérébrale et qui peut en être affecté?
Les MAV sont rares et généralement acquises (non héréditaires). Statistiquement, une MAV est diagnostiqué chez 1,34 personne sur 100 000 chaque année. En Suisse, cela représente environ 120 personnes par an. Leur prévalence est estimée à 0,14 % de la population *, *. Les patients souffrant du syndrome d'Osler-Rendu-Weber ont un risque accru de développer une MAV (environ 5 à 13 % des personnes touchées *).
Quels sont les symptômes?
Les MAV sont le plus souvent diagnostiquées chez les jeunes adultes. Elles sont la principale cause d'hémorragie intracrânienne chez cette population *. Les symptômes les plus courants sont généralement *, *, *:
- hémorragies cérébrales avec des symptômes de type accident vasculaire cérébral (40-70 %)
- crises d'épilepsie (10 à 30 %)
- déficits neurologiques
- maux de tête
Quel est le risque de saignement?
Les risques de saignement liés à une MAV sont liés à plusieurs facteurs. En général, les MAV diagnostiquées à la suite d'une hémorragie cérébrale présentent un risque d'hémorragie subséquente plus élevé que les MAV diagnostiquées en raison d'autres symptômes ou de manière accidentelle.
Une méta-analyse portant sur 18 études et 8 418 patients atteints de MAV a montré un risque annuel moyen d'hémorragie de 2,2 % pour les MAV non rompues et de 4,3 % pour les MAV ayant déjà saigné (MAV rompues) *. Au cours de la première année suivant le diagnostic, le risque d'hémorragie est plus élevé : 2,9 % pour les MAV non rompues et de 6 à 33 % pour les MAV rompues. *, *
Outre les saignements dans le passées, d'autres facteurs potentiels de risque accru de rupture semblent être:
- le drainage veineux profond
- une ectasie (dilatation) veineuse
- la présence d’anévrismes intracrâniens*.
Selon les résultats des plus grandes études de cohorte, la mortalité liée à une rupture de MAV est d'environ 25 %, et le risque de dommages permanents est d'environ 50-60 %. *, *, *, *, *, *
Traitement et consultation à l'Inselspital
Compte tenu de la complexité de la malformation, de son tableau clinique et des différentes options de traitement, une évaluation interdisciplinaire est indispensable. Les images des patients atteints d'une MAV sont discutées et évaluées en détail par des experts dans le domaine de la neurochirurgie, de la neuroradiologie et de la radiothérapie lors de notre colloques hebdomadaire multidisciplinaire
Toutes les décisions concernant un éventuel traitement de la MAV mettent en balance le risque d'hémorragie spontanée de la MAV non traitée et le risque du traitement ou de la combinaison de plusieurs traitements. Le traitement multimodal vise à réduire, dans les cas spécifiques, le risque de complications par rapport à un traitement singulier.
Comment les MAV sont-elles classées?
Il existe plusieurs échelles de classification utilisées pour classer les MAV, qui aident les médecins à mieux évaluer le risque de traitement d'un MAV. Les plus répandus sont :
- l'échelle Spetzler-Martin (5 niveaux)
- l'échelle simplifiée de Spetzler-Ponce (3 niveaux A, B et C) *, *
- l'échelle Spetzler-Martin augmentée *
L'échelle de Spetzler-Martin prend en compte la taille de la MAV, sa localisation près/dans des zones éloquentes du cerveau et les caractéristiques du drainage sanguin veineux de la MAV.
Comment est traitée une MAV ?
Pour les MAV de bas grade (grades I-III de Spetzler-Martin) un traitement est généralement recommandé car le risque de saignement sans traitement est de 2 à 2,5 % par an, ce qui est plus en principe plus élevé que le risque de complications liées au traitement.
Pour les MAV de haut grade (grade IV-V de Spetzler-Martin), compte tenu des risques liés au traitement, l’on privilégie en principe une prise en charge conservatrice par des suivis réguliers. Si les MAV de haut grade saignent de manière répétée ou en cas de déficits neurologiques invalidants, un traitement multimodal (embolisation, radiochirurgie, chirurgie) peut être pris en considération.
Embolisation
L'embolisation est l'occlusion des vaisseaux par voie endovasculaire (par un cathéter). Dans la plupart des cas, le cathéter rejoint le cerveau en passant par l'artère inguinale, et est par la suite avancé au niveau des artères vascularisant le nidus de la MAV (artéres dites « feeders »). L’angiographie par substraction digitale (DSA) est utilisée pour vérifier la position dans la MAV et celle-ci (ou une partie) peut être embolisée. Cette procédure peut fermer complètement jusqu'à 30 % des MAV. Elle est également souvent utilisée dans les MAV de grade moyen à haut (grade 3 de Spetzler-Martin) comme préparation à la chirurgie pour réduire le risque de saignement pendant l'opération. Les anévrismes qui peuvent se former à proximité des MAV sont aussi souvent fermés au moyen d'un traitement endovasculaire (coiling).
Microchirurgie
La chirurgie a comme but une exérèse totale de la MAV, ce qui élimine son risque de saignement. Dans certains cas, l'occlusion endovasculaire (embolisation, voir ci-dessus) des vaisseaux qui alimentent la MAV (feeders) peut être envisagée avant la chirurgie proprement dite. Cela peut réduire le risque de saignement pendant l'opération. Au cours de l'opération, les artères de la MAV (nourrisseurs) sont fermées une à une jusqu'à ce que le nidus entier soit coupé de son apport en sang et ne soit donc plus vascularisé. Souvent, les vaisseaux cérébraux normaux passent également à proximité de la MAV et doivent être distingués et disséqués. Ce n'est que lorsque tous les canaux d'alimentation sont obstrués que la veine peut être fermée et que la MAV peut être ôtée du cerveau.
Radiochirurgie
La radiochirurgie stéréotaxique peut être envisagée dans les cas où la MAV se situe au plus profond du cerveau ou concerne des fonctions cérébrales importantes. Elle est principalement utilisée pour traiter les petites MAV (nidus de taille inférieure à 3 cm). La radiochirurgie entraîne un épaississement de la paroi interne des vaisseaux, appelé hyperplasie de l’intima, ce qui conduit à une lente occlusion des vaisseaux sur une période de 2 à 3 ans. Pendant ce temps, le risque de rupture de la MAV persiste. En outre, en fonction de la dose totale de rayonnement administrée, des complications telles que la nécrose cérébrale par rayonnement peuvent survenir. *
Résultats du traitement de la MAV
Une méta-analyse et une revue systématique de la littérature rapportant les résultats de tous les traitements des MAV a montré les chiffres suivants quant à la guérison (oblitération complète) chez les patients atteints de MAV *:
| Occlusion complète | Taux de complication | |||
|---|---|---|---|---|
| SM I–II | SM III | SM I–II | SM III | |
| Embolisation | ca. 45 % | ca. 45 % | 6–24 % | 6–24 % |
| Radiochirurgie (5y) | ca. 70 % | ca. 70 % | 6 % | na |
| Microchirurgie | > 98 % | > 98 % | 5–10 % | 15–20 % |
-
Choi J, Mohr J. Brain arteriovenous malformations in adults. The Lancet Neurology. 2005;4(5):299-308.
-
Laakso A, Dashti R, Seppänen J, Juvela S, Väärt K, Niemelä M et al. Long-term Excess Mortality in 623 Patients with Brain Arteriovenous Malformations. Neurosurgery. 2008;63:244-255.
-
Willemse R, Mager J, Westermann C, Overtoom T, Mauser H, Wolbers J. Bleeding risk of cerebral vascular malformations in hereditary hemorrhagic telangiectasia. Journal of Neurosurgery. 2000;92(5):779-784.
-
Al-Shahi R. A systematic review of the frequency and prognosis of arteriovenous malformations of the brain in adults. Brain. 2001;124(10):1900-1926.
-
Derdeyn C, Zipfel G, Albuquerque F, Cooke D, Feldmann E, Sheehan J et al. Management of Brain Arteriovenous Malformations: A Scientific Statement for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2017;48(8).
-
Fullerton H, Achrol A, Johnston S, McCulloch C, Higashida R, Lawton M et al. Long-Term Hemorrhage Risk in Children Versus Adults With Brain Arteriovenous Malformations. Stroke. 2005;36(10):2099-2104.
-
Goldberg J, Raabe A, Bervini D. Natural history of brain arteriovenous malformations: systematic review. Journal of neurosurgical sciences. 2018;62(4):437‐443.
-
Graf C, Perret G, Torner J. Bleeding from cerebral arteriovenous malformations as part of their natural history. Journal of Neurosurgery. 1983;58(3):331-337.
-
Mast H, Young W, Koennecke H, Sciacca R, Osipov A, Pile-Spellman J et al. Risk of spontaneous haemorrhage after diagnosis of cerebral arteriovenous malformation. The Lancet. 1997;350(9084):1065-1068.
-
Gross B, Du R. Natural history of cerebral arteriovenous malformations: a meta-analysis. Journal of Neurosurgery. 2013;118(2):437-443.
-
Brown R, Wiebers D, Forbes G, O'Fallon W, Piepgras D, Marsh W et al. The natural history of unruptured intracranial arteriovenous malformations. Journal of Neurosurgery. 1988;68(3):352-357.
-
Crawford P, West C, Chadwick D, Shaw M. Arteriovenous malformations of the brain: natural history in unoperated patients. Journal of Neurology, Neurosurgery & Psychiatry. 1986;49(1):1-10.
-
da Costa L, Wallace M, ter Brugge K, O'Kelly C, Willinsky R, Tymianski M. The Natural History and Predictive Features of Hemorrhage From Brain Arteriovenous Malformations. Stroke. 2009;40(1):100-105.
-
McAllister J, Eskandari R, Limbrick D: Youmans & Winn neurological surgery. 2017
-
Ondra S, Troupp H, George E, Schwab K. The natural history of symptomatic arteriovenous malformations of the brain: a 24-year follow-up assessment. Journal of Neurosurgery. 1990;73(3):387-391.
-
van Beijnum J, van der Worp H, Buis D, Salman R, Kappelle L, Rinkel G et al. Treatment of Brain Arteriovenous Malformations. JAMA. 2011;306(18):2011.
-
Spetzler R, Martin N. A proposed grading system for arteriovenous malformations. Journal of Neurosurgery. 1986;65(4):476-483.
-
Spetzler R, Ponce F. A 3-tier classification of cerebral arteriovenous malformations. Journal of Neurosurgery. 2011;114(3):842-849.
-
Lawton M, Kim H, McCulloch C, Mikhak B, Young W. A Supplementary Grading Scale for Selecting Patients With Brain Arteriovenous Malformations for Surgery. Neurosurgery. 2010;66(4):702-713.
-
Vlaskou Badra E, Ermiş E, Mordasini P, Herrmann E. Radiosurgery and radiotherapy for arteriovenous malformations: outcome predictors and review of the literature. J Neurosurg Sci. 2018;62(4):490‐504.